Загадкова хімія води
Пориньте в загадкову хімію води та спробуйте докопатися до суті її незвичайних властивостей
Від її унікальних фізичних властивостей до її критичної ролі в підтримці життя на Землі, вода, безсумнівно, є дивною та чудовою. Наука тільки наздоганяє свою приховану дивовижність – два типи рідких структур при дуже низьких температурах. Тривають дослідження, щоб зрозуміти, що означають ці структури в контексті біології та Сонячної системи.
Що відрізняє воду?
Вода може виглядати як інші рідини, але вона точно не поводиться як вони. Однією з найбільш очевидних властивостей води є те, що лід менш щільний, ніж рідка вода, і тому плаває на поверхні. Це не те саме для інших рідин. Наприклад, заморожені краплі алкоголю відразу впадають на дно ємності, наповненої рідким спиртом.

Більшість речовин під час замерзання стискається, а вода розширюється. Коли температура падає, а молекули води сповільнюються, щоб замерзнути в твердий стан, вони утворюють кристалічну решітку з відкритою гексагональною структурою, яка забезпечує меншу щільність. Кожна молекула води в льоду утворює водневі зв’язки з чотирма іншими. Вода має найбільшу щільність при 4°C, що гарантує, що дно озера чи моря ніколи не замерзне, захищаючи таким чином водні організми. Ця максимальна щільність також допомагає воді циркулювати в океанах.
Вода, яку часто називають універсальним розчинником, має дивовижну здатність розчиняти широкий спектр речовин. Ця властивість є важливою для життя, оскільки вода транспортує поживні речовини та мінерали в живих організмах. Полярність води з позитивно зарядженою областю біля атомів водню та негативно зарядженою областю біля атома кисню робить її ефективним розчинником для іонних сполук.
У середньому вода становить від 60 до 75% маси тіла людини. Рідина відіграє важливу структурну роль у клітинах, і майже всі хімічні реакції в життєвих процесах відбуваються у розчині у воді. Працюючи з ферментами, вода може розщеплювати або гідролізувати молекули в організмі, наприклад, розщеплюючи великі вуглеводи на менші, такі як глюкоза, або розщеплюючи жири на складові гліцерин і жирні кислоти. Ферменти також можуть керувати зворотним процесом для видалення води, щоб прості цукри могли з’єднатися з утворенням складних вуглеводів, або гліцерин та інші молекули могли утворити жири чи ліпіди.
Крута наука

Дивні властивості води значно посилюються, коли її переохолоджують і залишаються рідкою при температурах, значно нижчих за точку замерзання. Це переохолодження можливе лише тоді, коли вода надчиста, без домішок, які можуть викликати утворення льоду. Можна охолодити дуже чисту воду приблизно до -40°C без кристалізації льоду.
Ви можете побачити, як переохолоджена вода кристалізується вдома, якщо поставити невідкриту пляшку надчистої води вертикально в морозилку. Поруч поставте іншу пляшку з водопровідною водою. Коли водопровідна вода замерзне, обережно вийміть пляшку з чистою водою з морозильної камери, перш ніж раптово стукнути по ній, щоб іскрилася кристалізація.
Нижче -20°C рідина, здавалося, була на межі певного перетворення, але не існувало технології, щоб це спостерігати
Переохолоджена вода зазвичай утворюється в атмосфері, особливо в
хмарах. Хмарні краплі можуть існувати в переохолодженому стані, оскільки в них
відсутні місця зародження або частинки, що утворюють лід. Ця переохолоджена вода раптово замерзає під час контакту з частинками,
такими як пил або інші кристали льоду, або коли її турбують. Наприклад, коли переохолоджені краплі рідкої води взаємодіють із
падаючими сніжинками, вони можуть утворювати снігові гранули, які іноді
називають крупою.
Дивні властивості
Переохолоджена вода має «багато дивних властивостей», пояснює Сандер Воутерсен з Амстердамського університету. Наприклад, її питома теплоємність і питомий об’єм зростають зі зниженням температури, тоді як у всіх інших рідинах відбувається навпаки.
У 1976 році Остен Енджелл і колега Робін Спіді експериментували, щоб побачити, наскільки сильно вони можуть переохолодити воду і як рідина буде поводитися при екстремальних температурах. Коли температура води опустилася нижче -20°C, її стисливість і питома теплоємність почали зростати, що свідчить про коливання густини. Здавалося, рідина була на порозі якоїсь трансформації, але не існувало технології, щоб це спостерігати.
В останні десятиліття вчені створили комп’ютерні моделі, щоб спробувати зрозуміти, що відбувається з водою при екстремальних температурах. Одна із запропонованих теорій полягає в тому, що переохолоджена вода може мати дві різні структурні форми. Після багатьох років бурхливих дебатів на цю тему вчені тепер розуміють, що певна дивина води пов’язана з її здатністю існувати у вигляді двох макроскопічних фаз, каже Андерс Нільссон зі Стокгольмського університету в Швеції.
«Існування такого фазового переходу рідина-рідина в переохолодженій воді було дуже суперечливим питанням. Це було важко спостерігати експериментально, оскільки передбачалося, що перехід відбудеться при такій низькій температурі, що навіть найчистіша вода замерзне, перш ніж ви зможете це спостерігати», — каже Сандер. Експерти в цій галузі давно називають цю важливу область температур і тиску, де переохолоджена вода швидко кристалізується, «нічиєю землею».
Гіпотеза двох рідин
Енджелл був «піонером у дослідженні цих таємничих властивостей переохолодженої води», — каже Сандер. У 2018 році він «розробив простий і елегантний метод» дослідження систем з переохолодженням шляхом додавання спеціального типу антифризу, який запобігає замерзанню, але не змінює структуру води.
Сандер був частиною команди, яка працювала з Енджеллом над використанням антифризу трифторацетату гідразинію, який ідеально підходить до мережі водневих зв’язків у воді. Коли вони охолоджували воду, вони використовували інфрачервону спектроскопію для вимірювання коливань зв’язків O–H. Під час охолодження, близько -80°C, дослідники спостерігали різку зміну структури рідини, що супроводжувалося виділенням тепла. Здається, ця робота підтверджує перехід рідина-рідина, припускаючи фази високої та низької щільності.
Вони спостерігали раптову зміну структури, яка вказує на перехід рідина-рідина на нічийній землі
У 2020 році Андерс очолив велику міжнародну групу дослідників, які спостерігали перехід рідина-рідина в чистій переохолодженій воді без необхідності додавання антифризу. По-перше, вони розробили нові експерименти з використанням рентгенівських лазерних імпульсів для дослідження зразків при тиску близько атмосферного та перевірки гіпотези двох рідин. Вони створили дуже тонкий потік крихітних крапель, невидимих неозброєним оком, які вони переохолодили, щоб побачити, як структура постійно змінюється при охолодженні.
Потім вони підготували зразки під тиском і при досить низькій температурі, щоб молекули води залишалися статичними. Вони нагрівали ультратонкі шматочки льоду короткими інфрачервоними імпульсами, що викликало швидке розширення з наступною декомпресією. Вони досліджували систему за допомогою рентгенівського розсіювання з різними часовими затримками під час декомпресії та спостерігали раптову зміну структури, яка вказує на перехід рідина-рідина на нічийній землі.
Вони також описали виявлення кристалізації льоду, що відбувається в більш тривалих масштабах часу, підтверджуючи, що перехід рідина-рідина відрізняється від переходу рідина-лід. Сандер і його колеги описали експерименти як "вражаючі".
Рідка вода при надзвичайно низьких температурах не тільки відносно стабільна, але також існує у двох структурних станах
2020 рік був роком водних одкровень. Витративши понад 25 років на вивчення рідини, команда під керівництвом фізиків-хіміків Брюса Кея та Грега Кіммела з Тихоокеанської північно-західної національної лабораторії Міністерства енергетики США також опублікувала дослідження, які показують рідку воду високої та низької щільності при переохолоджених температурах.
Вони створили тонкі плівки льоду, які вони закривали наносекундними лазерними імпульсами, щоб створити переохолоджену рідку воду перед швидким охолодженням до вихідної температури. Вони використовували інфрачервону спектроскопію для моніторингу змін у структурі води до її повторного замерзання. Цей метод чутливий до конфігурації водневих зв’язків молекул води, демонструючи структурні зміни. Дослідники кажуть, що дослідження показало, що рідка вода за надзвичайно низьких температур не тільки відносно стабільна, але також існує у двох структурних мотивах.
Незважаючи на те, що дослідження, здається, вирішують питання про існування фазового переходу рідина-рідина в переохолодженій воді, «залишається ще багато запитань», каже Сандер. «Наприклад, які відмінності в структурі та динаміці двох рідких форм переохолодженої води і які фактори визначають, чи може рідина зазнати переходу рідина-рідина?»
Попереду багато роботи. Дослідники в цій галузі кажуть, що дослідження можуть допомогти нам зрозуміти, як рідка вода може існувати на дуже холодних планетах нашої Сонячної системи, таких як Юпітер, Сатурн, Уран і Нептун. Вони також можуть допомогти зрозуміти дивовижність води тут, на Землі, зокрема складні процеси в кожній клітині нашого тіла. Наступного разу, коли ви зробите ковток води або похлюпаєтесь у морі, подумайте на хвилинку про те, яка дивна та чудова ця рідина.
ОБОРОТНІ РЕАКЦІЇ ТА РІВНОВАГА
Нам часто важко зрозуміти концепцію того, що хімічні реакції є оборотними та існують у точці рівноваги. Оборотні реакції та рівновага лежать в основі багатьох тем глобального значення, включаючи економіку процесів Габера та Контакту, зміни клімату та підкислення океану . Зв’язування кисню з гемоглобіном і підтримка рН нашої крові є ще одним чудовим контекстом, який допоможе студентам зрозуміти актуальність оборотності та рівноваги.
Що потрібно знати
Порогові поняття
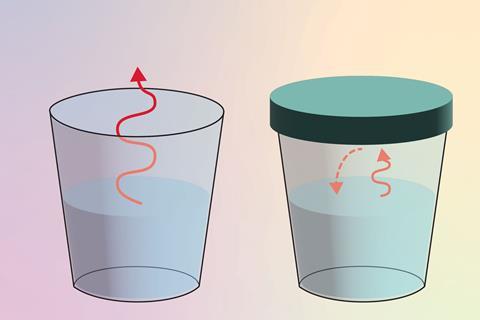
Що відбувається, коли ми залишаємо в кімнаті відкритий стакан з водою? Ви можете сказати, що з часом рівень води в склянці зменшиться, оскільки вода випаровується в атмосферу. Тоді ми можемо запитати: що станеться, коли ми матимемо ту саму склянку, але з кришкою? Учні можуть припустити, що рівень води залишатиметься постійним (макроскопічне спостереження), оскільки швидкість випаровування та конденсації однакові (субмікроскопічне пояснення). Явне (символічне) написання рівнянь цих реакцій може допомогти їм розвинути розуміння різних поглядів на хімічні зміни:
Коли учні це зрозуміють, розгляньте інші реакції, які можна змінити, змінивши умови, наприклад розкладання хлориду амонію . У цій реакції хлорид амонію (тверда речовина) термічно розкладається з утворенням аміаку та хлористого водню (гази) при нагріванні. Однак, коли дати газам охолонути, відбувається зворотна реакція. Іншим хорошим прикладом звичайної оборотної реакції є (де)гідратація мідного купоросу .Ви иску розс
Ви можете переглянути комплекси кобальту, щоб допомогти студентам розвинути розуміння положення рівноваги: [Co(H 2 O) 6 ] 2+ + 4Cl – ⇌ [CoCl 4 ] 2– + 6H 2 O. У розчині з низьким вмістом концентрації хлориду кобальт утворює з молекулами води рожевий комплекс. Зі збільшенням концентрації хлориду кобальт утворює синій комплекс з іонами хлориду.
Починаючи із суміші двох комплексів, яка має фіолетовий колір, дослідіть фактори, які впливають на положення рівноваги , зокрема концентрацію та температуру. Додавання хлориду спричиняє зміщення положення рівноваги вправо, тому розчин забарвлюється з фіолетового в синій. Ми пояснюємо цю зміну за допомогою принципу Ле Шательє, який стверджує, що рівновага буде зміщуватися проти зміни. Зрушення в положенні рівноваги (через більшу відносну концентрацію [CoCl 4 ] 2– ), яке є субмікроскопічною зміною, спостерігається макроскопічно як зміна кольору (більше блакитної сполуки, менше рожевої сполуки).
Принцип Ле Шательє може пояснити ефект зміни температури реакцій. При нагріванні реакції положення рівноваги зміщується. Додаткова енергія поглинається системою, що сприяє ендотермічній реакції. Цей експеримент також показує, що до рівноваги можна наблизитися з будь-якого боку. Перемістіть пробірку із сумішшю між гарячою та холодною водяними ваннами та спостерігайте, як змінюється колір туди-сюди.
Знищення помилкових уявлень
Студенти часто думають, що оскільки в стані рівноваги немає спостережуваних макроскопічних змін, швидкість прямої та зворотної реакцій дорівнює нулю, або що в реакційному контейнері не відбувається жодних змін. Діагностичні запитання можуть допомогти розкрити погляди учнів. Уявні експерименти, як-от розгляд того, що ви спостерігаєте макроскопічно, коли йдете ескалатором з тією ж швидкістю, що й він рухається вниз, можуть допомогти учням розпізнати це хибне уявлення. Симуляції та моделі також можуть допомогти учням зрозуміти, що відбувається під мікроскопом.
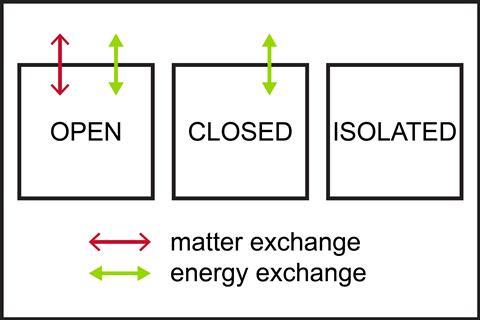
Студенти, можливо, не розглядали різницю між відкритими, закритими та ізольованими системами. Використовуйте прості діаграми, щоб узагальнити різні типи систем.
Учні часто думають, що концентрація реагентів і продуктів є рівноважною, і тому плутають концентрацію та швидкість. Попросіть їх намалювати графіки залежності концентрації (реагентів і продуктів) від часу та швидкості (прямої та зворотної реакцій) від часу, щоб показати, що відбувається при досягненні рівноваги. Підкресліть, що в стані рівноваги концентрації постійні (але не обов’язково рівні), а швидкості постійні (і завжди рівні).
Учні можуть розглядати пряму та зворотну реакції окремо одна від одної, припускаючи, що одну можна змінити без іншої. Реакція є однією системою, і що зміна будь-якого компонента вплине як на пряму, так і на зворотну реакції.

Немає коментарів:
Дописати коментар